2025-03-03
双膦酸盐背景概述
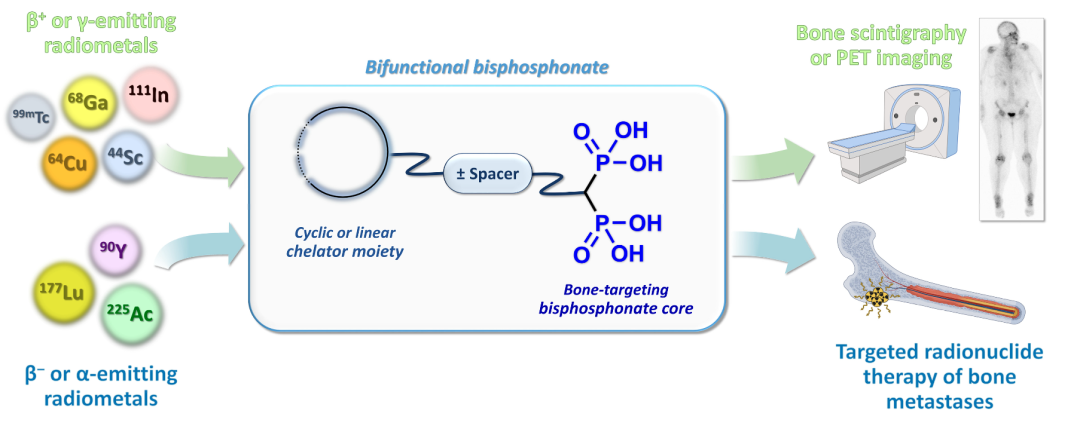
骨转移又称为转移性骨病,是某些原发于骨组织以外的恶性肿瘤经血行转移至骨组织引起的以骨损害、疼痛为主要表现的疾病,骨改良药物是一类旨在缓解因骨转移引起的 SREs 药物的总称,目前主要包括双膦酸盐类药物和 RANKL 抑制剂(本文仅讨论双膦酸盐类药物)。在核医学中,使用最普遍的诊断核药99mTc标记的双膦酸盐衍生物,如全身核素骨显像剂亚甲基二磷酸盐(99mTc‐MDP)和羟亚甲基二磷酸盐(99mTc‐HMDP),已作为骨单光子发射计算机断层扫描(SPECT)成像剂使用了超过40年。这类诊断核药在肿瘤学和非肿瘤学领域都有广泛应用,包括肿瘤分期、治疗反应评估以及良性骨疾病的诊断。1968年第一个双膦酸盐被报道;1977年,第一代的依替膦酸钠(Etidronate)由美国的宝洁(P&G)公司开发上市。基于依替膦酸钠开发的治疗性双膦酸盐核药如[188Re]Re-Etidronate也已进行了临床研究,显示出一定的疗效和改善患者生活质量的潜力。

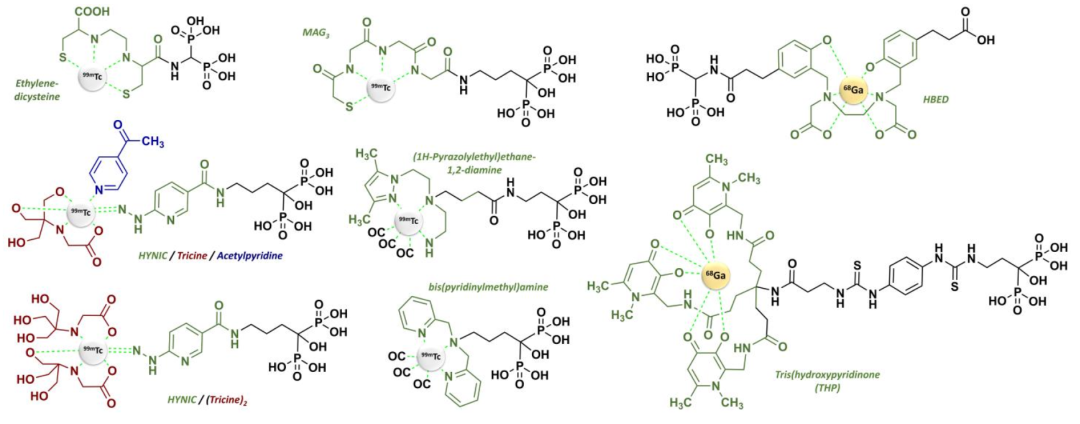
双膦酸盐分子中P-C-P结构是其产生抑制骨吸收活性的必要条件。双膦酸盐分子中磷酸根上的氧原子能与钙离子螯合,形成二配位体从而抑制骨吸收。双膦酸盐类药物的药效强度取决于各药的碳原子上取代侧链的类型,即C原子上的R1和R2侧链取代基(上图所示),R1侧链取代基主要参与双膦酸盐与骨基质中的羟基磷灰石的结合,决定了双膦酸盐分子在体内能否迅速而选择性地结合到骨基质表面。R2侧链取代基对双膦酸盐类药物抗骨质吸收的强度起着重要作用。一些双膦酸盐如第一代的依替膦酸钠(Etidronate)和氯屈膦酸钠(Clodronate)被破骨细胞摄取后代谢为非水解的具有潜在细胞毒性的腺苷三磷酸 (adenosine triphosphate, ATP) 类似物,并在细胞内大量堆积,使得ATP不能作为能量来源,从而抑制许多细胞内代谢性相关蛋白酶,对破骨细胞的生长起到抑制作用,促进破骨细胞凋亡,而达到抑制骨吸收的作用。
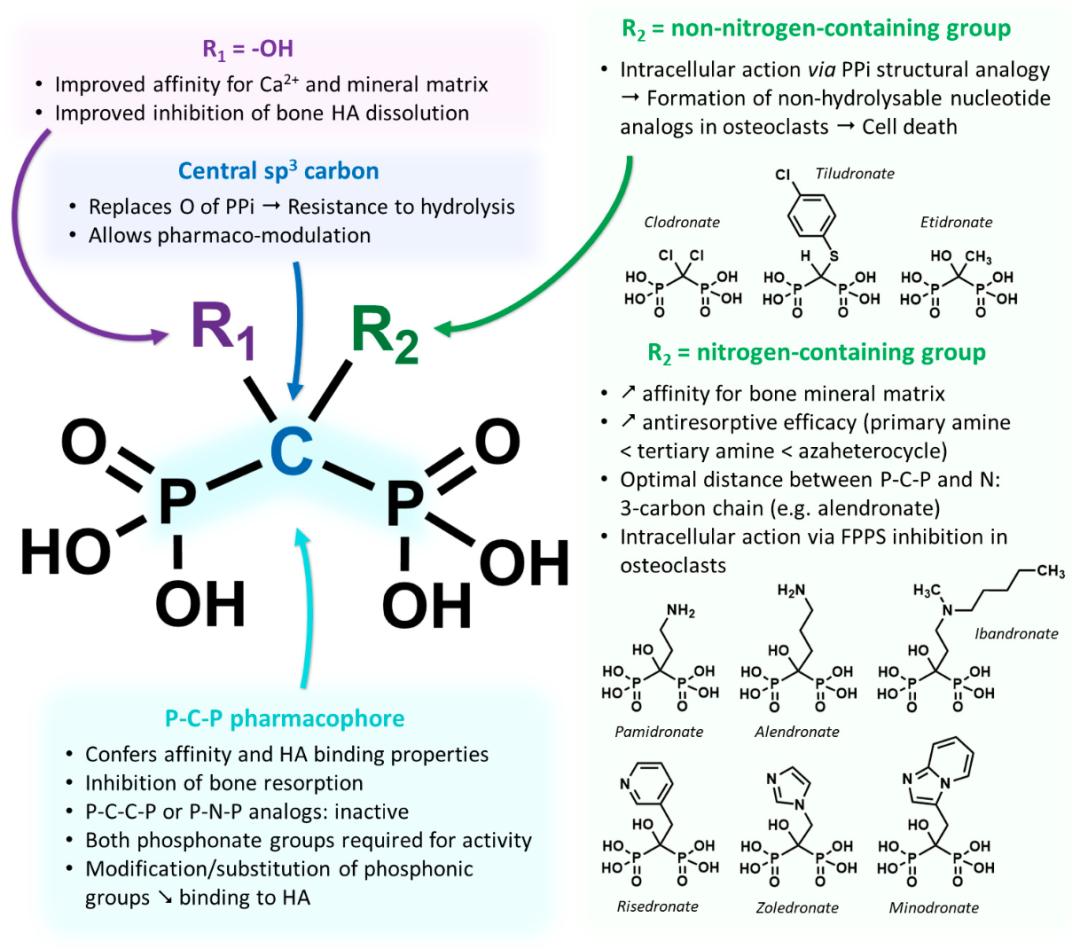
R2侧链决定生物活性,对其抗骨质吸收的强度起着重要作用,取代基侧链的长短对双膦酸盐的活性起决定性作用,适宜的碳链长度可提高药物的稳定性和生物利用度。第三代双膦酸盐含有含氮R2侧链,其抑制骨吸收和抗骨折能力显著增加,如具有杂环结构的含氮双膦酸盐唑来膦酸钠( Zoledronate),显示出更强的抗吸收效果。这些含氮双膦酸盐通过抑制甲羟戊酸生物合成途径中的关键酶,如法尼基焦磷酸合酶(Farnesyl pyrophosphate synthase,FPPS)来发挥其作用。第二代双膦酸盐以侧链含氨基为主要特点,抗骨质吸收的作用明显优于第一代双膦酸盐;第三代双膦酸盐药物的结构特点为在保留氨基中氮原子的基础上,进一步延长侧链长度或引入环状结构,其抗骨吸收作用更强。
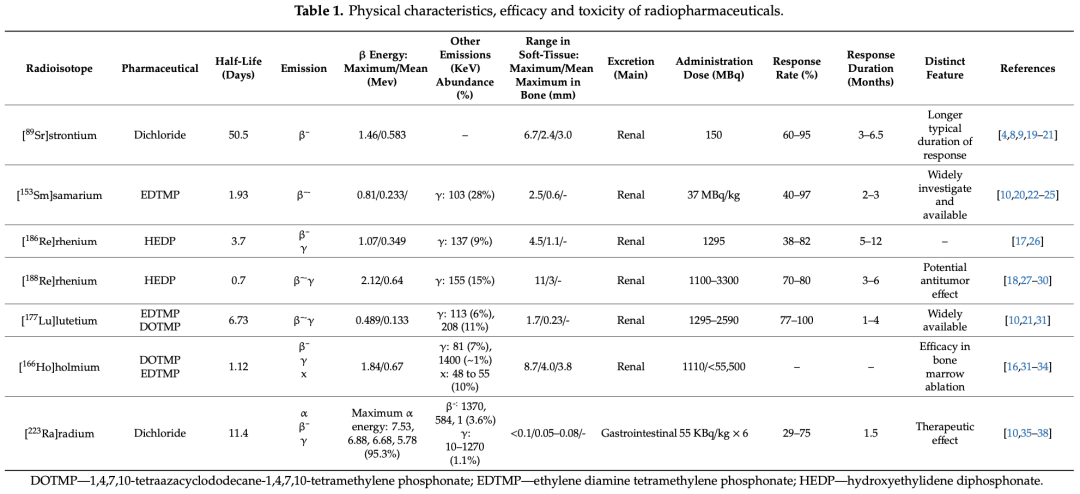
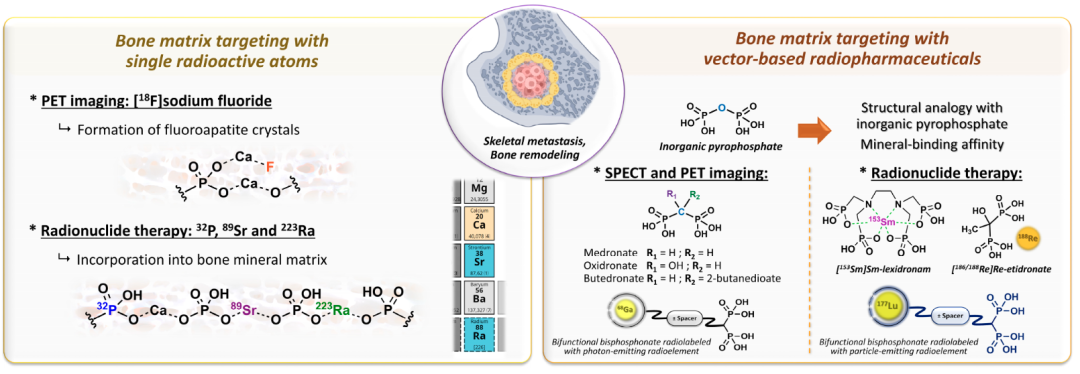
骨靶向放射性药物在缓解骨痛方面展现出显著的优势,同时也面临着一些挑战。这些药物能够同时治疗多个转移灶,具有可重复性,并且可以与其他治疗方法(如化疗、放疗等)联合使用,以增强治疗效果。例如,氯化锶(89Sr)注射液和[153Sm]钐-EDTMP等药物在缓解骨痛方面表现出较高的响应率,分别为60-95%和40-97%,并且疼痛缓解通常在给药后数天内开始,持续时间可达数月。此外,多菲戈®(氯化镭[223Ra]注射液)不仅在缓解疼痛方面有效,还在延长生存期方面显示出显著优势,尽管其成本较高且全球可用性有限。骨靶向放射性药物也存在一些问题,比如这些药物的疗效在不同患者之间存在差异,部分患者可能对治疗无响应;放射性药物的使用受到患者肾功能、骨髓储备和预期寿命等因素的限制。因此,开发易于获取、成本效益高且疗效显著的新骨靶向放射性药物迫在眉睫。
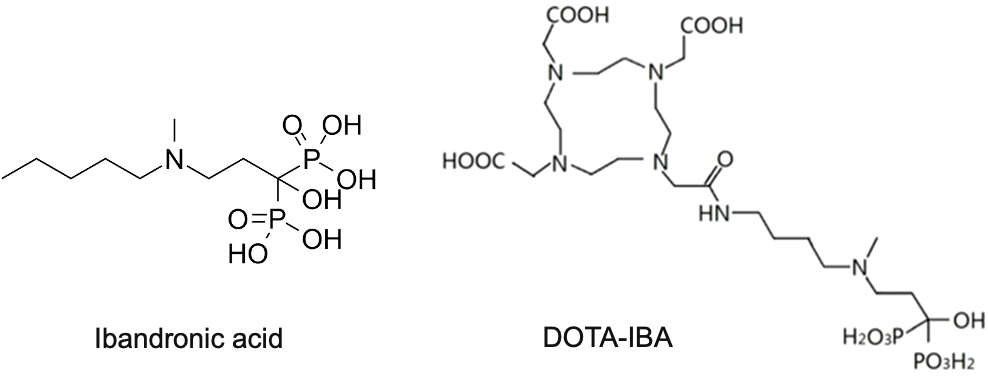
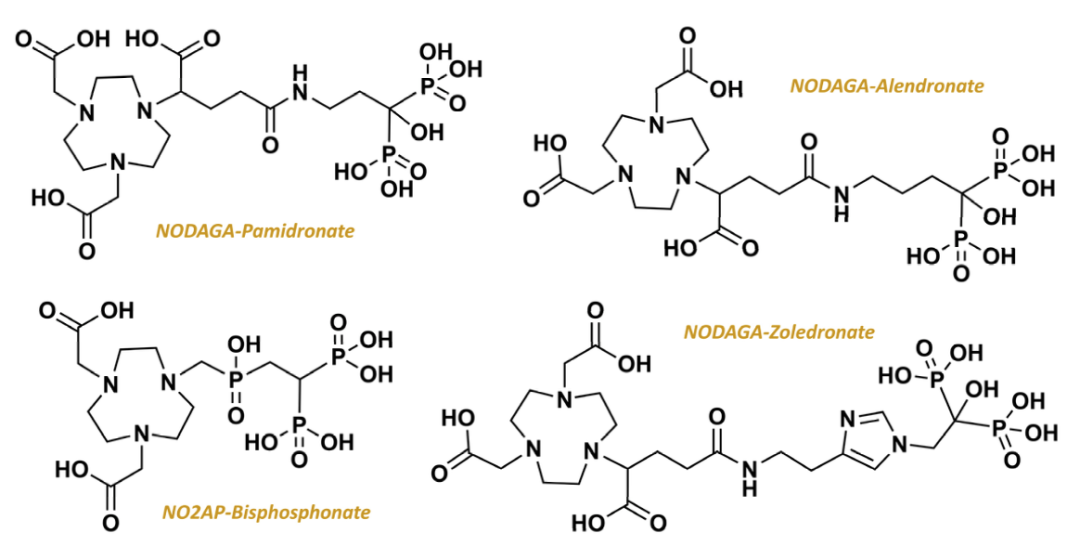
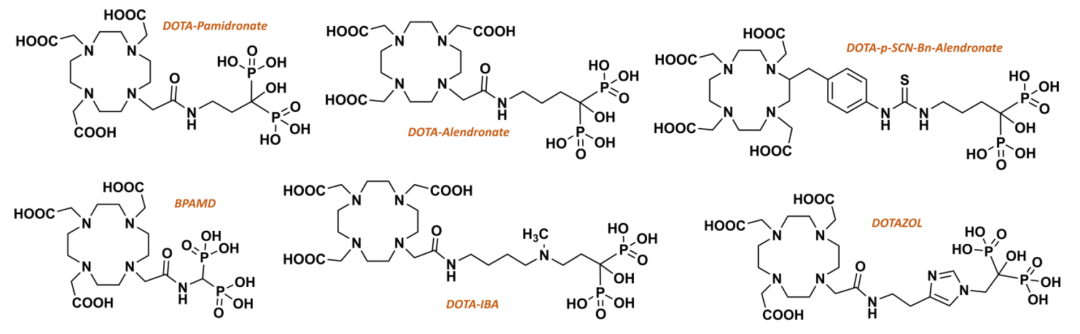
伊班膦酸钠(Ibandronate)是由瑞士罗氏制药公司开发的第三代双膦酸盐类,注射剂最早于1996年在欧盟获批上市,用于治疗恶性肿瘤所致高钙血症及多发性骨髓瘤和实体瘤的骨转移等,并可预防和治疗骨质疏松症,是目前适应证最广的双膦酸盐药物,其特点是高效、作用时间长、低毒、使用方便、可以长间歇给药等。2019年,伊班膦酸钠注射液(Bondronat)在国内上市,目前伊班膦酸钠注射液已被纳入中国医保乙类药品范畴,米内网数据显示,2022年该药物在中国公立医疗机构终端销售额突破10亿元大关,市场前景广阔。西南医科大学附属医院核医学科团队在基于该结构成功开发出新型放射性药物(68Ga/177Lu-DOTA-IBA),该药物展现出诸多优异特性,药代动力学表现良好,即便在低剂量下也能发挥出显著的疗效,且耐受性强,未出现明显不良反应,为患者带来了新的希望。

2021年11月,西南医科大学附属医院核医学科开发并完成了骨靶向核药TBM-001的发明专利申请(CN114230610A已授权)、PCT国际专利申请(WO2023092830A1);2022年12月8日,四川科伦博泰生物医药股份有限公司与西南医科大学附属医院在泸州举行了“生物靶向药物国家工程研究中心”共建揭牌仪式暨工作推进会议,此次双方成功转化签约,将促进我国镓68/镥177诊疗一体化放射性药物发展;2023年9月14日,西南医科大学附属医院发明专利成果转化签约仪式成功举行,四川科伦博泰生物医药股份有限公司向西南医科大学附属医院支付合同首付款及开发里程碑共计3850万元获得TBM-001项目的全球独家权益,包括在全球范围内开展项目的研究、开发、生产、商业化推广以及全球的分许可权利,泸州市人民政府副市长罗素平,西南医科大学副校长聂敏海,科伦集团董事长刘革新,科伦博泰总经理葛均友,西南医科大学附属医院书记徐勇、院长江涌等出席此次签约仪式。
截至2024年6月,已有一千多例,来自多个国家、地区的骨转移患者接受TBM的诊治,并从中获益,是一种很有前途的靶向治疗骨转移、控制骨转移进展、提高晚期骨转移患者生存率和生活质量的放射性药物。近日发表在Clin Nucl Med (IF=10.6)期刊的一项研究共纳入69名骨转移患者,旨在评估177Lu-DOTA-IBA在治疗肿瘤骨转移中的疗效和安全性。

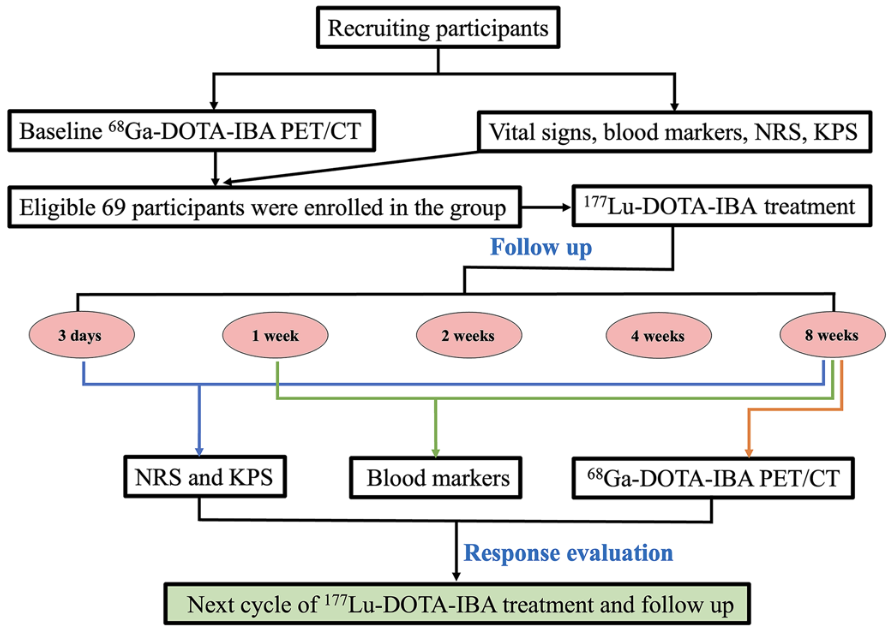
这项研究(ChiCTR2200064487)为单中心、单臂、前瞻性临床研究,于2021年11月至2023年2月进行。研究纳入年龄≥18岁、经组织学证实的恶性肿瘤且通过99mTc-MDP骨扫描确认的多发骨转移患者,要求治疗前4周内未接受放化疗,且预计生存期至少3个月。排除标准包括99mTc-MDP骨扫描呈超扫描现象、脊髓压迫或病理性骨折、合并DIC或严重骨髓造血功能障碍以及妊娠或哺乳期。治疗时,静脉注射370-2590 MBq的177Lu-DOTA-IBA,并进行生理盐水冲洗。治疗后,密切监测患者的生命体征和一般状况,包括疲劳、发热、恶心、呕吐、腹泻和食欲变化等。在治疗后3天、1周、2周、4周和8周评估KPS和疼痛评分,1、2、4和8周评估血液生物标志物。治疗后8周进行68Ga-DOTA-IBA PET/CT评估影像学反应。根据患者的意愿和临床情况决定后续治疗。
这项研究与以往研究相比,样本量更大,多剂量给药比例更高,确认了177Lu-DOTA-IBA在缓解骨痛方面的疗效。与其他放射性药物相比,177Lu-DOTA-IBA的疼痛缓解率相似,但直接比较存在困难。
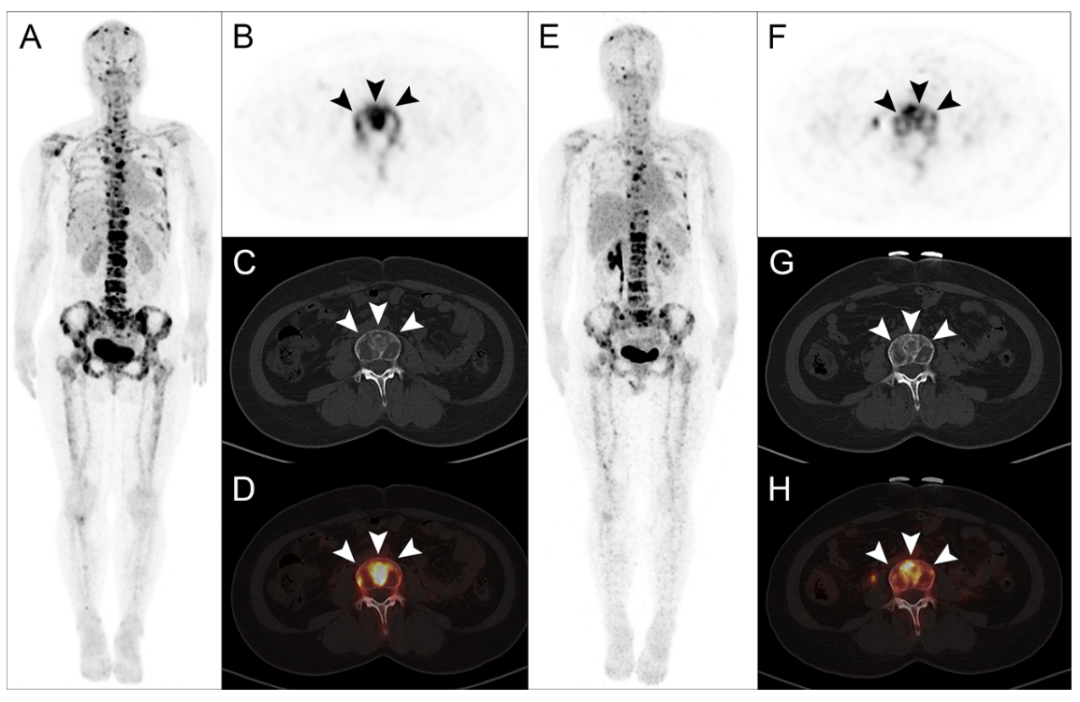
一位33岁的乳腺癌骨转移患者在接受了1850 MBq的177Lu-DOTA-IBA治疗后,其疼痛症状在短短一周内便得到了完全缓解,而其Karnofsky表现状态(KPS)评分也在两周后升至100分。在治疗后的8周随访中,通过68Ga-DOTA-IBA PET/CT影像复查发现,该患者的骨转移病灶示踪剂摄取量显著下降,SUVmax值从治疗前的高水平降至10.2,综合影像学与临床表现,该患者的治疗效果被评定为部分反应(PR),这一结果印证了177Lu-DOTA-IBA在缓解疼痛、提升生活质量方面的卓越能力,彰显了其在促进骨转移病灶修复、改善患者预后方面的巨大潜力。
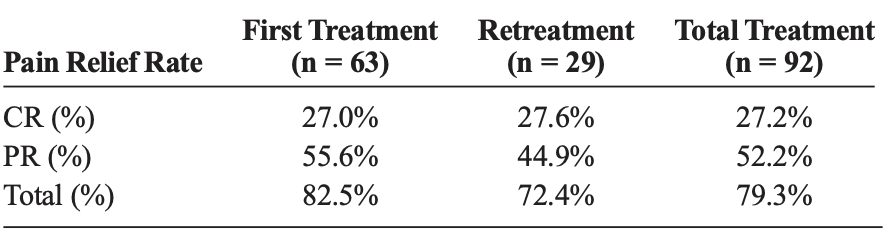
总之这项最新的研究结果显示177Lu-DOTA-IBA治疗后,患者的疼痛缓解率和Karnofsky表现状态(KPS)改善率均较高,分别为79.3%和74.2%。影像学评估显示,部分缓解率达到27.1%,表明该药物在影像学上也具有一定的疗效。此外,不良血液学事件的总发生率为15%,主要为轻度或中度,显示出良好的安全性。总体而言,177Lu-DOTA-IBA作为一种骨靶向放射性药物,在缓解骨转移患者的疼痛、改善生活质量以及在影像学上取得一定疗效方面表现出显著的优势,且具有良好的耐受性,为骨转移的治疗提供了一种有前景的新选择,为患者带来福音。
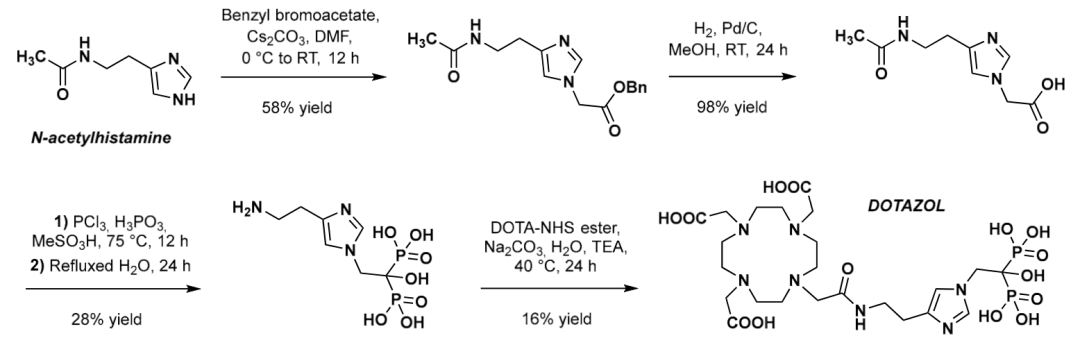
唑来膦酸(zoledronicacid)是继帕米膦酸二钠(pamidronate)之后的第3代二膦酸盐类(diphosphonates)药物注射用唑来膦酸浓溶液由诺华公司开发,于2000年首次在加拿大上市,2001年8月首次在美国获批上市,2008年原研药品在我国获批上市,目前已在欧盟、美国等80多个国家广泛使用,基于此开发的放射性药物便是177Lu-DOTA-唑来膦酸 ( 177Lu-DOTA-ZOL),上图为Meckel等人(Frank Rösch教授为通讯作者)在2017年发表的关于DOTAZOL的合成路线。
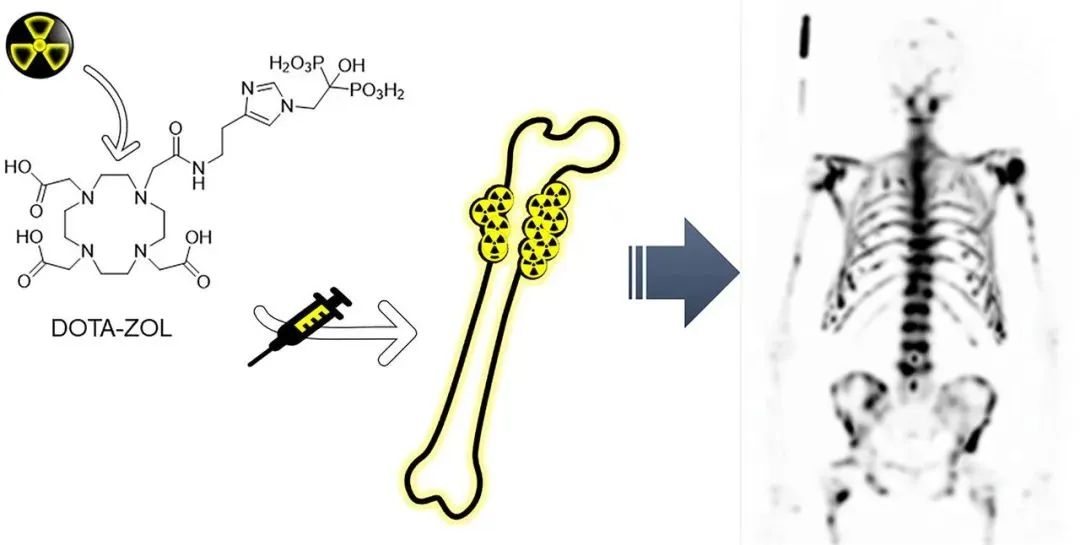
2021年1月,这项纳入9例患有去势抵抗性前列腺癌(mCRPC)且仅存在骨转移的患者,评估了177Lu-DOTA-唑来膦酸(177Lu-DOTA-ZOL)在治疗骨转移中的安全性与剂量学临床研究结果公布。患者接受单次治疗剂量的177Lu-DOTA-ZOL(平均5,780 MBq),随后在7天内进行多次三维全身SPECT/CT成像及静脉血样采集,以评估主要器官和肿瘤病灶的剂量学。结果显示177Lu-DOTA-ZOL在所有患者中均显示出快速摄取和在骨病灶中的高滞留,以及从血液中的快速清除。在该研究队列中,骨肿瘤病灶、肾脏、红骨髓和骨表面的平均吸收剂量分别为4.21Gy/GBq、0.17Gy/GBq、0.36Gy/GBq和1.19Gy/GBq,红骨髓被确定为剂量限制器官,中位最大耐受注射剂量为6.0GBq,可能使个别患者(4/8)的红骨髓剂量超过2Gy阈值,因此该研究认为,应考虑个性化剂量学给药以避免个别患者出现严重的血液毒性。

2015年8月,ITM集团宣布其子公司ITG GmbH成功引进了DOTA-Zoledronate这种用于骨靶向放射性核素治疗和诊断骨转移的药物,将其孵化至商业化市场;2021年12月27日,远大医药(512.HK)集团与德国ITM Isotope Technologies Munich SE达成产品战略合作,远大医药将按照产品审批进度和销售情况,支付不超过5.2亿欧元的授权签约费及里程碑款项,以获得ITM公司开发的3款全球创新型放射性核素偶联药物(RDC)在大中华区(中国大陆、香港、澳门、台湾)的独家开发、生产及商业化权益,包含这款用于治疗恶性肿瘤骨转移的ITM-41(177Lu-zoledronate);2022年02月,远大医药与德国ITM 订立股权投资协议,以2,500万欧元认购ITM公司的新股份,等于其扩大后股本的约1.31%。此次股权投资将会进一步加深远大医药与ITM公司的战略合作,为公司在全球进行放射性核素药品的产、研、销之全产业链布局奠定了坚实的基础。
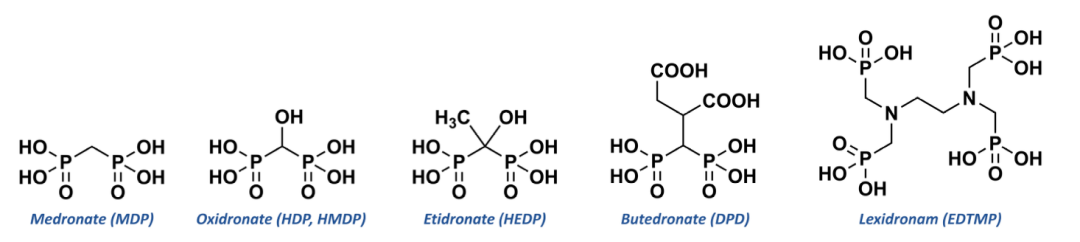
同类药物还有铼[188Re]依替膦酸盐注射液。前文已提到,1977年,这款第一代双膦酸盐药物依替膦酸钠上市,依替膦酸盐(HEDP)作为一种亲骨性化学药物,其作用机制明确且安全性高,作为最早上市的双膦酸盐类药物,依替膦酸二钠通过与骨表面的羟磷灰石结合,抑制破骨细胞活性。然而其药物活性和结合力相对较弱,可能导致骨钙化抑制、干扰骨形成,甚至诱发骨折。基于此结构开发的铼[188Re]依替膦酸盐注射液,188Re-羟基亚乙基二膦酸盐(hydroxyethylidenediphosphonate,HEDP,188Re-HEDP)是一种具有显著疗效的放射性药物能缓解转移性骨痛并改善健康相关生活质量和生存时间。
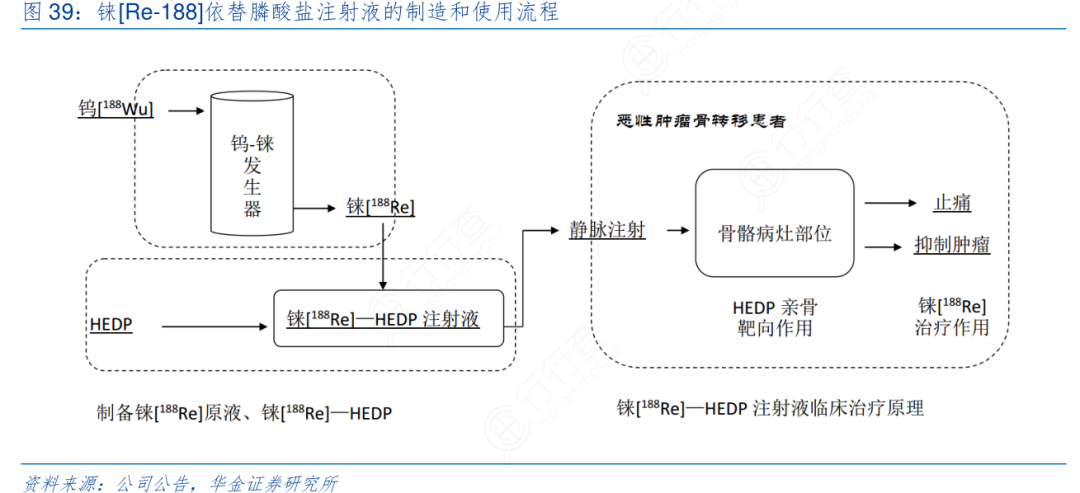
铼[188Re]依替膦酸盐注射液由东诚益泰与中国科学院上海应用物理研究所共同开发,属于Ⅰ类骨靶向放射性治疗药物,主要用于恶性肿瘤骨转移治疗,现已完成Ⅱ期临床试验。放射性核素188Re可发射β射线和γ射线,半衰期约为17h。其中,β射线的最大能量约为 2.12MeV。高能的β射线在软组织的最大射程为10.4mm,平均的穿透深度为3.1mm,适合内照射治疗。HEDP对骨骼中的羟基磷灰石(HAP)有很强的亲和力,被放射性核素188Re标记后,可以使放射性核素188Re导向分布,并聚集在骨质上,尤其是骨转移病灶部位,从而发挥对骨转移病灶的辐射生物效应。

2001年的一项临床研究包括61名患有肺癌、前列腺癌、乳腺癌、肾癌、鼻咽癌和膀胱癌等不同类型晚期癌症的患者,这些患者接受了1.1GBq(31mCi)到6.9GBq(188mCi)的188Re- HEDP治疗。治疗后,患者在最初的两个月内每周接受一次随访,之后每月随访一次,最长随访时间为1年。此外,该研究在治疗前后6周内还进行了血液功能测试。疼痛反应根据三点疼痛评分量表(完全缓解、显著缓解和最小缓解)进行评估。研究结果显示,总体上80%的患者在治疗后迅速且显著地缓解了骨痛。具体到不同肿瘤类型,肺癌患者中77%、前列腺癌患者中80%、乳腺癌患者中83%、膀胱癌患者中100%、肾癌患者中50%、鼻咽癌患者中50%以及其他肿瘤类型患者中87%的疼痛得到了缓解,且未出现严重的副作用或血液毒性。总之,这项大规模临床试验验证了Re-188 HEDP作为一种有效的放射性药物,在治疗各种肿瘤类型引起的疼痛性骨转移方面具有显著疗效。
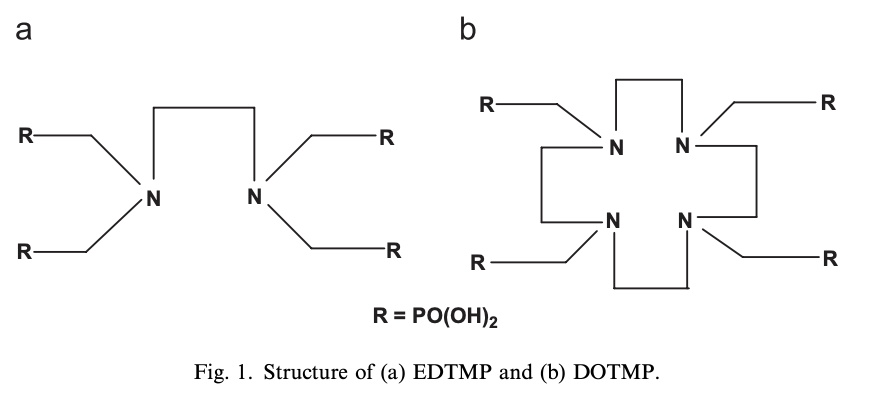
自20世纪80年代末以来,一种与乙二胺四甲基膦酸盐(EDTMP)相关的双膦酸盐衍生物,被用153Sm (t1/2 = 1.9days; Eβ-max = 0.81MeV) 放射性核素标记,用于缓解由骨转移引起的疼痛。两项临床试验表明,与安慰剂相比,这种标记的双膦酸盐在缓解疼痛方面有效,并且与89Sr和32P相比,其毒性特征有所改善,这表明153Sm-EDTMP作为一种放射性药物,在骨转移疼痛管理中显示出一定的疗效和安全性,为患者提供了一种治疗选择。Ethylenediaminetetramethylene phosphonic acid (EDTMP) 与1,4,7,10-tetraazacyclododecane-1,4,7,10-tetramethylene phosphonic acid (DOTMP) 属于不同的螯合剂,都是多氨基磷酸类配体,以此开发的核药分别为153Sm-EDTMP与153Sm-DOTMP。EDTMP是线性配体,而DOTMP是环状配体,二者在结构、性质和应用上有显著区别,DOTMP相较于EDTMP而言,与放射性金属离子结合时更为稳定,主要用于放射性药物的制备,特别是在骨靶向治疗和诊断中;在生物分布上,两者都浓聚在骨组织,但 DOTMP 的血液清除速度比 EDTMP 快,153Sm-DOTMP已在临床前和早期临床试验中显示出安全性、有效性。
QSAM 的CycloSam® (Samarium-153 DOTMP) 最早是由 IsoTherapeutics Group LLC 开发的,2024年2月7日,Telix Pharmaceuticals Limited宣布与QSAM Biosciences, Inc.签署收购协议,旨在收购QSAM及其主要药物Samarium-153-DOTMP(153Sm-DOTMP)。此次收购旨在为Telix的前列腺癌治疗特许经营权提供一个补充和早期商业切入点。2024年5月2日,Telix宣布完成对QSAM的收购,步入商业孵化阶段。